miozin spada u motorne proteine i između ostalog je odgovoran za procese koji sudjeluju u kontrakciji mišića. Postoje različite vrste miozina koji svi sudjeluju u transportnim procesima staničnih organela ili u pomacima unutar citoskeleta. Strukturna odstupanja u molekularnoj strukturi miozina mogu pod određenim okolnostima biti uzrok mišićnih bolesti.
Što je miozin?
Uz dinin i kinezin, miozin je jedan od motornih proteina koji su odgovorni za procese kretanja stanica i transportne procese unutar stanice. Za razliku od ostala dva motorna proteina, miozin djeluje samo na aktin. Aktin je, pak, dio citoskeleta eukariotske stanice. Stoga je odgovoran za strukturu i stabilnost stanice.
Nadalje, aktin s miozinom i dva druga strukturna proteina tvore stvarnu kontraktilnu strukturnu jedinicu mišića. Dvije trećine kontraktilnih proteina u mišićima su miozini, a jedna trećina aktin. Međutim, miozini nisu prisutni samo u mišićnim stanicama, već i u svim ostalim eukariotskim stanicama. Ovo se odnosi na jednoćelijske eukariote kao i na biljne i životinjske stanice. Mikrofilamenti (aktinski filamenti) uključeni su u strukturu citoskeleta u svim stanicama i zajedno s miozinom kontroliraju protoplazmatske struje.
Anatomija i struktura
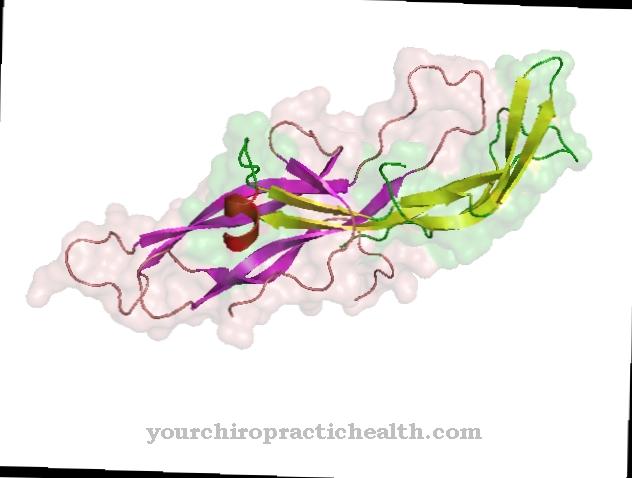
Miozini se mogu podijeliti u različite klase i potklase. Trenutno je poznato preko 18 različitih razreda, od kojih su najvažniji klase I, II i V. Miozin koji se nalazi u mišićnom vlaknu naziva se konvencionalnim miozinom i pripada klasi II. Struktura svih miozina je slična. Sve se sastoje od dijela glave (miozinske glave), dijela vrata i dijela repa.
Miozinski filamenti skeletnog mišića sastoje se od oko 200 molekula miozina II, svaka molekulska masa 500 kDa. Uzglavlje je genetski vrlo konzervativno. Podjela na strukturne klase uglavnom je određena genetskom varijabilnošću dijela repa. Dio glave veže se za molekulu aktina, dok vratni dio djeluje kao zglob. Repni dijelovi nekoliko molekula miozina akumuliraju se i tvore filamente (snopove). Molekula miozina II sastoji se od dva teška i četiri lagana lanca.
Dva teška lanca tvore takozvani dimer. Duži od dva lanca ima alfa-spiralnu strukturu i sastoji se od 1300 aminokiselina. Kraći lanac sastoji se od 800 aminokiselina i predstavlja takozvanu motoričku domenu, koja čini dio glave u molekuli, koji je odgovoran za kretanje i transportne procese. Četiri lagana lanca povezana su s glavom i vratom teških lanaca. Lagani lanci koji se nalaze dalje od glave nazivaju se regulatorni, a lakovi blizu glave kao esencijalni lanci. Vrlo su afiniti prema kalcijumu i na taj način mogu kontrolirati pokretljivost dijela vrata.
Funkcija i zadaci
Najvažnija funkcija svih miozina jest transport ćelijskih organela u eukariotskim stanicama i obavljanje pomaka unutar citoskeleta. Uobičajene molekule miozina II, zajedno s aktinom i proteinima tropomiozinom i troponinom, odgovorne su za kontrakciju mišića. Da bi se to postiglo, miozin se najprije integrira u Z-diskove sacomera koristeći protein titin. Šest titinskih filamenata fiksira miozinsku nit.
U sacomeru miozinska nitna tvore oko 100 križnih spojeva sa strana. Ovisno o strukturi molekula miozina i sadržaju mioglobina, može se razlikovati nekoliko oblika mišićnih vlakana. Kontrakcija mišića odvija se unutar sacomera zbog kretanja miozina u ciklusu cross-mosta. Prije svega, glava miozina čvrsto je vezana na molekulu aktina. Zatim se ATP podijeli na ADP, pri čemu oslobođena energija dovodi do napetosti glave miozina. Istovremeno, lagani lanci osiguravaju povećanje kalcijevih iona. Zbog toga se glava miozina vezuje za susjednu aktinsku molekulu kao rezultat konformacijske promjene.
Oslobađanjem stare veze, napetost se sada pretvara u mehaničku energiju takozvanim udarnim silama. Kretanje je slično udarcu vesla. Glava miozina se naginje od 90 stupnjeva do između 40 i 50 stupnjeva. Rezultat je pokret mišića. Tijekom kontrakcije mišića skraćuje se samo duljina sacomera, dok duljine aktinovih i miozinskih filamenata ostaju iste. Dostava ATP-a u mišiću dovoljna je samo oko tri sekunde. Razgradnjom glukoze i masti ADP se pretvara u ATP tako da se kemijska energija još uvijek može pretvoriti u mehaničku energiju.
bolesti
Strukturne promjene miozina uzrokovane mutacijama mogu dovesti do bolesti mišića. Primjer takve bolesti je obiteljska hipertrofična kardiomiopatija. Obiteljska hipertrofična kardiomiopatija je nasljedna bolest koja se nasljeđuje kao autosomno dominantno svojstvo. Bolest karakterizira zadebljanje lijeve komore bez dilatacije.
Sa prevalencijom od 0,2 posto u općoj populaciji, relativno je česta bolest srca. Ova bolest je uzrokovana mutacijama koje dovode do strukturnih promjena u betamyosin i alfhatropomyosin. Ovo nije jedna nego nekoliko točkastih mutacija proteina uključenih u strukturu sacomer-a. Većina mutacija smještena je na kromosomu 14. Patološki se bolest očituje zadebljanjem mišića u lijevoj komori.
Ova asimetrija debljine srčanog mišića može dovesti do kardiovaskularnih tegoba sa srčanim aritmijama, nedostatka daha, vrtoglavice, gubitka svijesti i angine pektoris. Iako mnogi pacijenti imaju slabo ili nimalo oštećenje rada srca, može se razviti progresivno zatajenje srca.





.jpg)