Objašnjavamo što je atom i kako je svaki njegov dio sastavljen. Također, njegova povijest, studije o tome i što je molekula.

Što je atom?
Najmanja jedinica koja čini materija.
Riječ atom dolazi iz starogrčkog (atom, "Bez podjele") i skovali su ga prvi filozofi da teoretiziraju o sastavu stvari, odnosno o elementarnim česticama svemir. Od tada, s pojavom atomski modeli, način njihovog zamišljanja je uvelike varirao, budući da je atomski model naslijedio prethodni kroz stoljeća, sve dok nismo došli do onog koji koristimo danas.
Atomi imaju svojstva kemijski element koji se sastoje i, zauzvrat, elementi su organizirani i razvrstani prema svojim atomski brojevi, elektronička konfiguracija i kemijska svojstva u Periodni sustav elemenata elemenata.
Isti kemijski element može biti sastavljen od različitih atoma iste klase, odnosno s istim atomskim brojem (broj protona koje svaki atom ima u elementu), iako su njihove atomske mase različite.
Na primjer, postoje različiti atomi istog elementa koji se razlikuju po broju neutroni, a nazivaju se izotopi, reprezentativan slučaj su izotopi elementa ugljika (12C, 13C, 14C). Dakle, svaki atom pripada istom kemijskom elementu ili ne, ovisno o broju protona, pa atomi s istim brojem protona pripadaju istom kemijskom elementu.
Kako je sastavljen atom?
Atomi se sastoje od jezgre i jednog ili više elektrona (koji imaju negativan naboj) oko nje. Jezgra se sastoji od čestica koje se nazivaju protoni i neutroni. Protoni su pozitivno nabijeni, a neutroni neutralni. Skup protona i neutrona naziva se nukleoni.
Protoni i elektroni međusobno se privlače elektromagnetskom silom (međudjelovanje nabijenih čestica s električnim i magnetskim poljima), dok se protoni i neutroni međusobno privlače nuklearnom silom (sila koju doživljavaju samo čestice koje čine atomska jezgra).
Kako se atomi spajaju?
Atomi se mogu međusobno kombinirati kako bi se formirali kemijske veze, što se događa kada dijele svoje elektrone na ovaj ili onaj način. Kemijske veze mogu biti kovalentna, ionski Y metalik, koji nastaje kovalentnim molekularnim spojevima, ionskim mrežama ili metalnim spojevima (iako je važno pojasniti da nijedna kemijska veza nije apsolutno kovalentna ili ionska). Na taj se način atomi mogu kombinirati u formiranje molekule jednostavan poput Voda, kao i oblikovati makromolekule složen poput protein, DNK Y RNA.
Iako se atomi razlikuju jedni od drugih zahvaljujući konfiguraciji svojih čestica, također je istina da su svi atomi istog elementa potpuno identični: atomi vodika u Sunce Oni su isti kao oni koji čine naše tijelo, a atomi ugljika u tijelu psa identični su onima koji čine dijamant. Razlika je u načinu na koji se atomi spajaju kako bi tvorili različite kemijske spojeve koji čine organe i organske sustave u živih bića, materijali nastali u industrija, i svu materiju koja čini svemir.
Dijelovi atoma
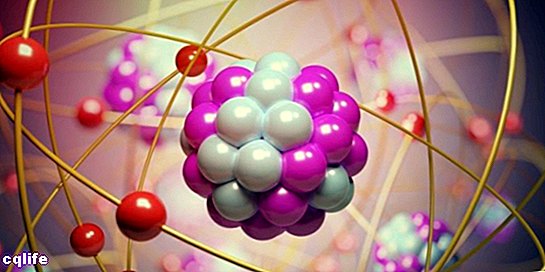
Atomi se sastoje od dva bitna dijela:
- Jezgra. Oko 99,94% mase atoma koncentrirano je u jezgri, gdje se nalaze protoni i neutroni (koji se zajedno nazivaju "nukleoni"), spojeni jakim nuklearnim silama, što sprječava protone koje se međusobno odbijaju, a imaju istu električnu energiju. naplatiti.
- Atomske orbitale. Orbitala opisuje područje prostora koje okružuje atomsku jezgru u kojoj je vjerojatnost pronaći elektron je vrlo visoka. Ove regije imaju različite oblike koji se dobivaju kao rezultat rješavanja stacionarne Schrödingerove jednadžbe. Erwin Schrödinger bio je austrijski znanstvenik koji je 1925. razvio ovu jednadžbu kako bi izračunao evoluciju subatomske čestice, kao što su elektroni. Dakle, elektroni tvore svojevrsni "oblak" oko jezgre, koji je predstavljen oblikom atomskih orbitala. S druge strane, svakoj atomskoj orbitali odgovara određena energetska vrijednost za elektrone, pa su oni organizirani prema svojim energetskim vrijednostima. Sljedeća slika prikazuje oblike prvih atomskih orbitala:

Povijest atoma

Prvi koji je formulirao ideju o postojanju atoma bio je grčki filozof Demokrit (s.V-VI pr. Kr.) iz čisto izmišljenih nagađanja (kako se u to vrijeme shvaćala znanost).
Njegovim proučavanjem su se bavili kasniji filozofi poput Leukipa i Epikura, ali su ga zanemarili tijekom srednjovjekovni, zasjenjena kreacionističkim objašnjenjem svijeta, koje je sve pripisivalo Bogu.
Morali smo čekati do 1773. godine kada je francuski kemičar Antoine de Lavoisier postavio svoju teoriju o nestvaranju ili uništavanju materije (ona samo transformira) ili Zakon održanja mase, što je Johnu Daltonu omogućilo da 1804. godine formulira prvu modernu atomsku teoriju.
Uzastopni znanstvenici fizički i kemija bili su inspirirani njegovim radom da predlože bolje i složenije sustave za razumijevanje temeljnih čestica materije. Nakon toga, predloženi su novi atomski modeli do onih koji se danas najviše koriste.
Suvremena prihvaćena struktura je ona koja proizlazi iz eksperimente Rutherforda 1911., zajedno s formulacijama Nielsa Bohra, Schrödingera i Heisenberga.
Molekula
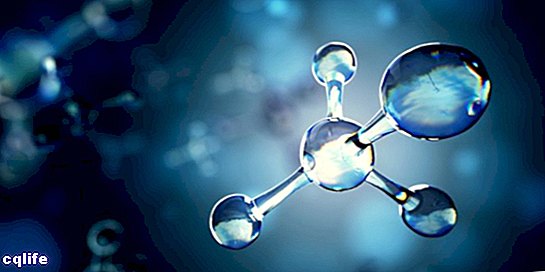
Molekula je poznata kao spoj dva ili više atoma putem kemijskih veza kako bi se formirala složenija i električni neutralna struktura. Kemijske veze mogu biti kovalentne ili ionske.
Molekule mogu biti sastavljene od atoma istog kemijskog elementa, na primjer, molekule kisika (O2), ili od atoma različitih kemijskih elemenata, na primjer, molekule glukoze. Monatomski plinovi, na primjer helij (He), također se smatraju molekulama.

